Ordonnance sur les dispositifs médicaux (ODim)
À partir du 01 juin 2021, ERP-Dental® R/1 répondra aux exigences de la réglementation applicable sur les dispositifs médicaux.
Après divers incidents, les mécanismes de contrôle des dispositifs médicaux sont renforcés à travers l'Europe. La Suisse révise également sa législation sur les dispositifs médicaux sur la base des différentes nouvelles réglementations de l'UE.
L'ordonnance sur les dispositifs médicaux (Annexe 3, article 10, paragraphe 1) réglemente le traitement de la fabrication et de la vente des pièces et composants. Pour la technologie dentaire, il est important, entre autres, d'assurer la traçabilité des matériaux. Cela nécessite une documentation complète dans la fabrication des matériaux et des produits semi-finis utilisés. ERP-Dental® R/1 fournit les processus et fonctions correspondants à cet effet.
ODim - Parties et composants
- Toute personne physique ou morale qui met à disposition sur le marché un article destiné à remplacer une partie intégrante ou un composant identique ou similaire d’un dispositif défaillant ou usé afin de maintenir ou de rétablir la fonction du dispositif sans en altérer les performances, les caractéristiques de sécurité ou la destination veille à ce que l’article ne compromette pas la sécurité et les performances du dispositif. Des pièces justificatives doivent être tenues à la disposition des autorités compétentes.
- Tout article qui est destiné à remplacer une partie ou un composant d’un dispositif et qui en change considérablement les performances, les caractéristiques de sécurité ou la destination est considéré comme un dispositif et doit satisfaire aux exigences énoncées par la présente ordonnance.
Cliquez ici pour la fiche d'information...
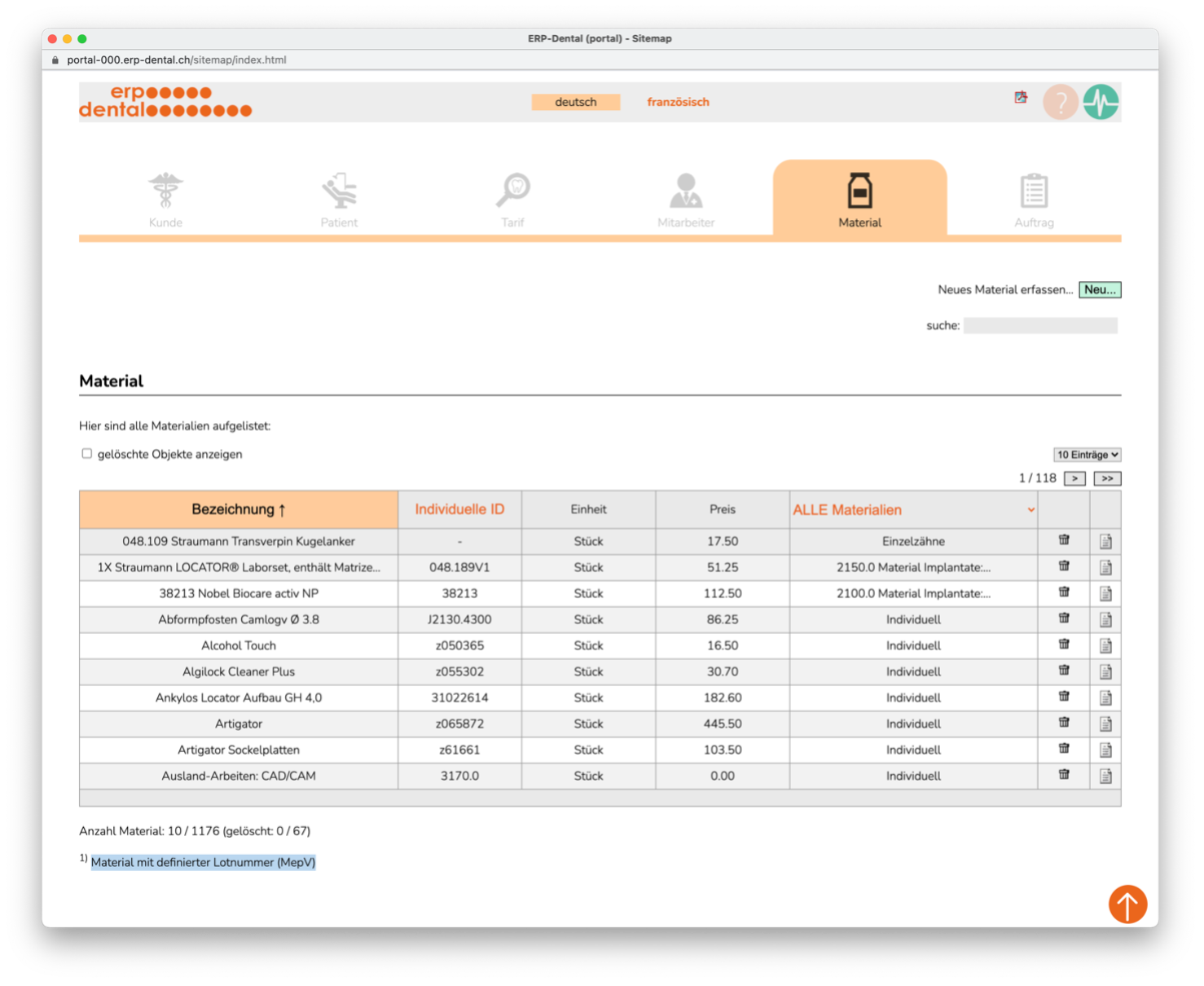
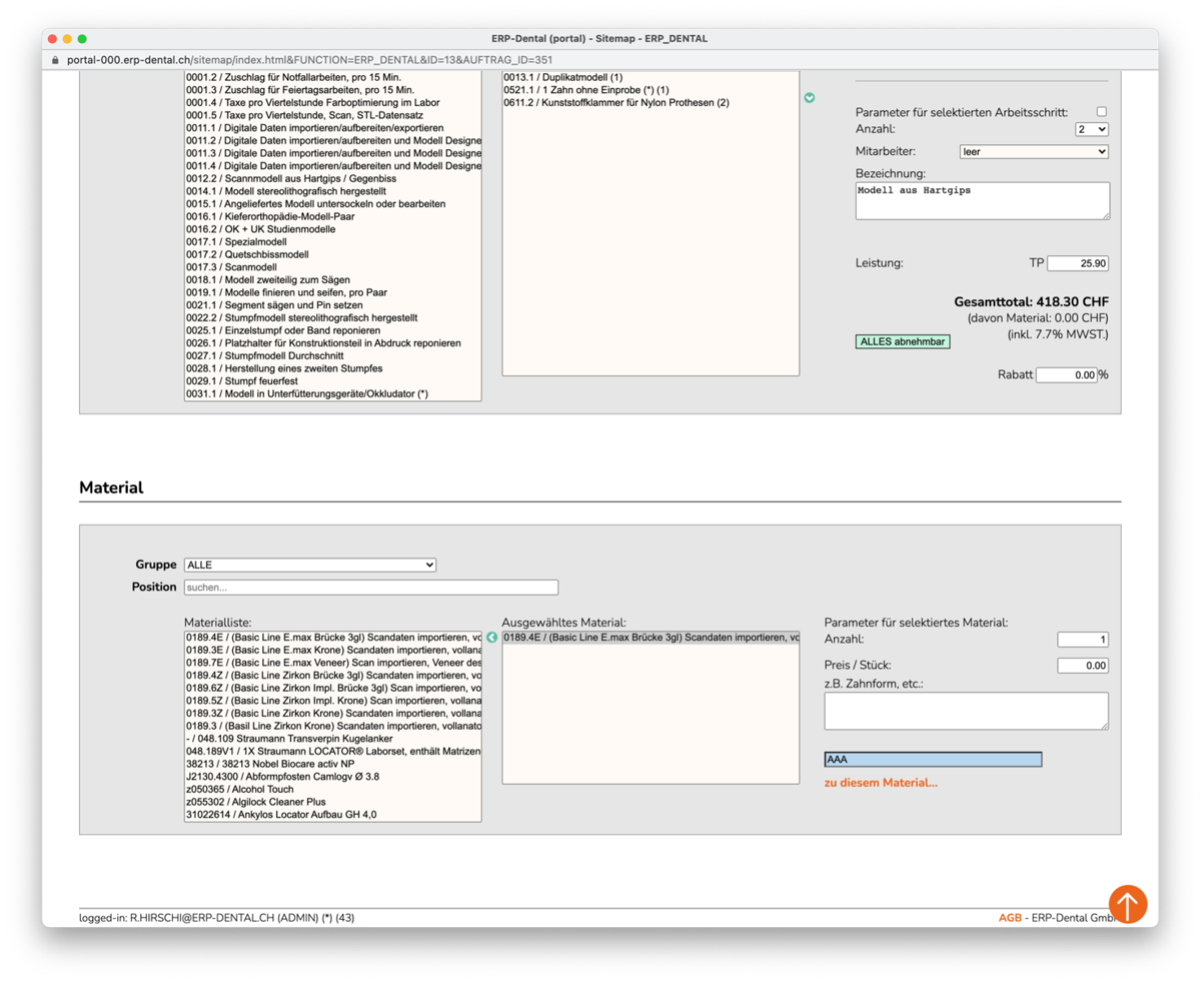
Matériel
Vous gérez vos positions matérielles comme d'habitude. Vous pouvez désormais stocker les numéros de lot de chaque article pendant un intervalle de temps défini. Le système affecte ensuite le numéro de lot valide pour l'article utilisé. C'est ainsi que vous assurez la traçabilité des matériaux conformément au règlement sur les dispositifs médicaux (ODim).
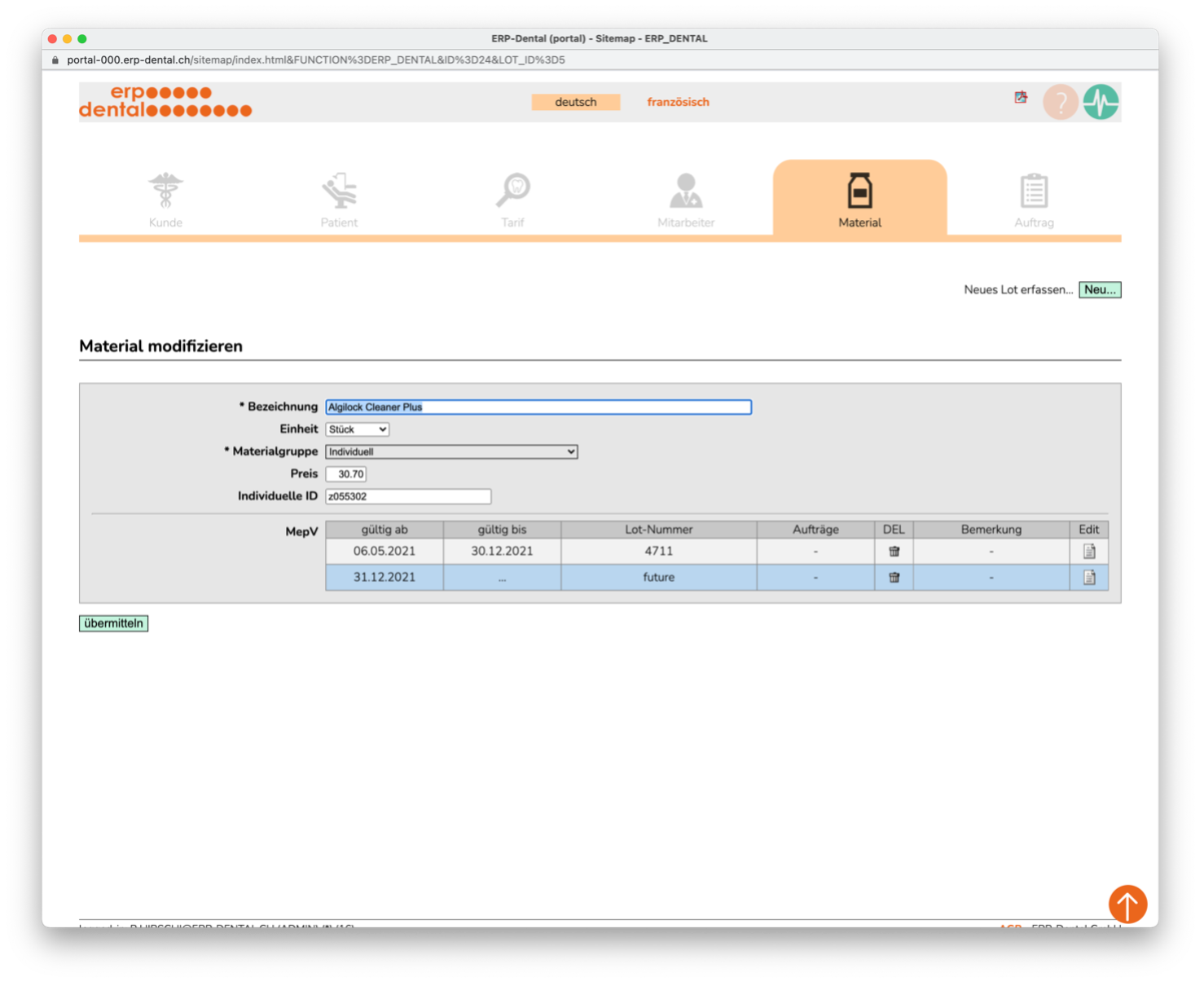
Numéros de lot
La période de validité est déterminée avec les numéros de lot. Cela garantit que le lot d'articles utilisé est affecté.
Position du matériau
Vous pouvez voir le numéro de lot valide pour chaque article utilisé dans le champ du numéro de lot (surligné en bleu). Si nécessaire, entrez ici directement un nouveau numéro de lot.
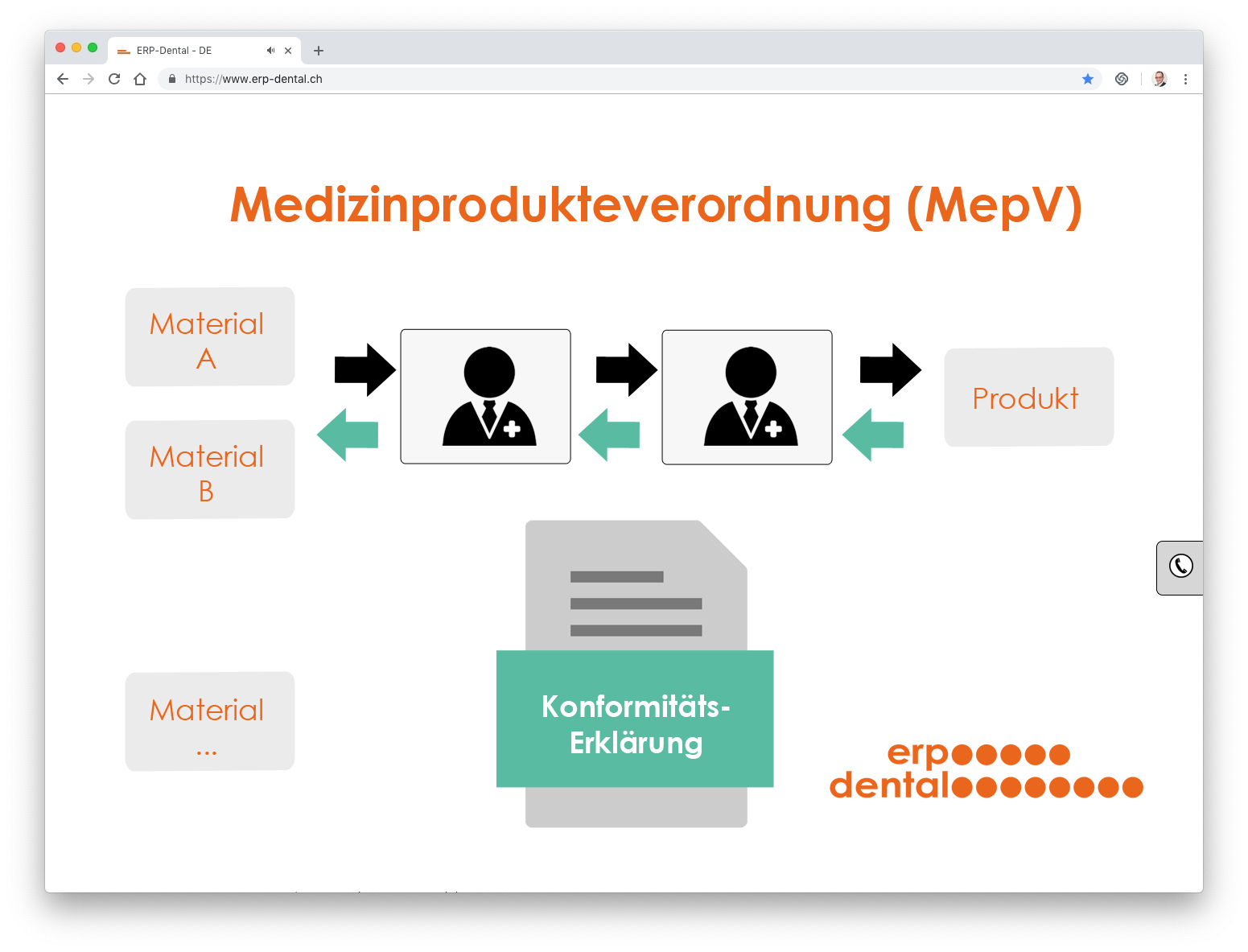
ODim
L'affectation des numéros de lot utilisés (lots d'articles) garantit que – en fonction du produit fabriqué – tous les articles utilisés peuvent être affectés à tout moment. La soi-disant déclaaration de conformité permet diverses évaluations, par exemple tous les détails sur: Client (prestataire de services) - patient - produit - commande - matériel (lot)








 retour au haut de page
retour au haut de page


